Hoe Bond Order en Bond-lengte te berekenen
 Share
Share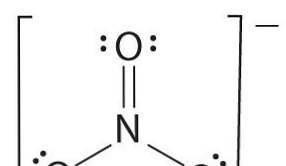
Bepaling van bepaalde parameters zoals grootte, lengte en hoek op atomaire schaal is niet eenvoudig. Vanwege het belang van deze parameters hebben wetenschappers methoden ontwikkeld om de parameters op atomair niveau af te leiden of te berekenen. Bondvolgorde en bindingslengte zijn twee van dergelijke belangrijke parameters die het type en de sterkte van bindingen tussen een paar atomen aangeven.
Dit artikel legt uit,
1. Wat zijn Bond Order en Bond-lengte
2. Hoe Bond Order en Bond-lengte te berekenen
- Hoe Bond Order te berekenen
- Hoe Bond-lengte te berekenen
Wat zijn Bond Order en Bond Length
Bindingslengte en volgorde van bindingen zijn twee parameters die geassocieerd zijn met covalente bindingen. Bondvolgorde is het aantal chemische bindingen tussen twee atomen en de bindingslengte is de afstand tussen twee kernen van atomen die covalent aan elkaar zijn gebonden.In dit artikel wordt uitgelegd hoe u de volgorde van de bindingen en de lengte van de bindingen op atomair niveau kunt berekenen.
Hoe Bond Order te berekenen
Bondvolgorde is het aantal chemische bindingen tussen twee atomen. Het geeft de stabiliteit van een binding aan. In covalente bindingen is de bindingsvolgorde het aantal gedeelde elektronen. De volgorde van bindingen van een paar atomen gebonden door een enkele binding is bijvoorbeeld één, terwijl de bindingsvolgorde van een paar atomen gebonden door een dubbele binding twee is. Geen volgorde van binding geeft aan dat er geen binding is tussen de atomen. De stabiliteit van een molecuul neemt toe naarmate de volgorde van de bindingen toeneemt. De moleculen met resonantiebinding hoeven geen geheel getal te zijn. In covalente verbindingen met twee atomen wordt de bindingsorde tussen een paar atomen bepaald door eerst de Lewis-structuur te tekenen en vervolgens het type bindingen tussen de atomen te bepalen - nulbinding, enkele, dubbele of drievoudige binding. De volgorde van de binding van waterstofgas wordt bijvoorbeeld als volgt bepaald.
- Teken de Lewis-structuur
H: H
- Bepaal het aantal bindingen / paar valentie-elektronen
Eén paar elektronen, dus de volgorde van de bindingen is 1.
Als er meer dan twee atomen zijn, wordt de volgorde van bindingen als volgt bepaald. Zie het voorbeeld: nitraation.
- Teken de Lewis-structuur

- Tel het totale aantal bindingen (volgens nitraation, de 4)
- Het aantal verbindingsgroepen tussen individuele atomen (volgens ammoniak, zijn 3)
- Daarom is de volgorde van de obligaties = Totaal aantal obligaties / aantal obligatiegroepen
= 4/3
= 1,33
Daarom is de bindingsvolgorde van nitraationen 1,33
Hoe Bond-lengte te berekenen
Bindellengte is de afstand tussen twee kernen van atomen die covalent aan elkaar zijn gebonden. De lengte van de binding ligt gewoonlijk in het bereik van 0,1 tot 0,2 nm. Wanneer twee vergelijkbare atomen aan elkaar worden gebonden, wordt de helft van de lengte van de binding aangeduid als covalente straal. De lengte van de binding hangt af van het aantal gebonden elektronen van twee atomen of de volgorde van de bindingen. Hoe hoger de volgorde van de bindingen, hoe korter de bindingslengte zal zijn vanwege sterke trekkrachten van positief geladen kernen. De eenheid van de lengte van de binding is picometer. In enkele, dubbele en drievoudige bindingen neemt de bindingslengte in de volgorde toe
drievoudige band Elektronegativiteit kan worden gebruikt om de lengte van de binding tussen twee atomen met verschillende elektronegativiteiten te berekenen. De volgende empirische formule werd voorgesteld door Shoemaker en Stevenson om de lengte van de binding te berekenen. dA-B = rEEN + rB - 0,09 (xEEN - XB) dA-B is bindingsafstand tussen twee atomen A en B, rEEN en rB zijn covalente stralen van A en B, en (XEEN - XB) is het elektronegativiteitsverschil tussen A en B. Een andere methode wordt gebruikt om de geschatte lengte van de binding te berekenen. Bij deze methode wordt de eerste Lewis-structuur getrokken om het covalente bindingstype te bepalen. Vervolgens gebruikmakend van een kaart * gemaakt op de studies uitgevoerd door Cordero et al., en Pyykkö en Atsumi, de overeenkomstige radii van de bindingen gemaakt door elk atoom worden bepaald. Vervolgens wordt de lengte van de binding bepaald door de som van de twee radii te nemen. Bij het bepalen van de bindingslengte van koolstofdioxide wordt bijvoorbeeld de eerste Lewis-structuur getrokken. Volgens de grafiek is de covalente straal van koolstof dubbele binding 67 picometer en die van zuurstof dubbele binding 57 picometer. Daarom is de lengte van de binding van koolstofdioxide ongeveer 124 picometer (57 pm + 67 pm). * Covalent grafiek is hier te vinden Referentie: Cordero, Beatriz, et al. "Covalent radii revisited." Dalton Transactions 21 (2008): 2832-2838. Libretexts. "Bondorder en lengtes." Chemistry LibreTexts. Libretexts, 5 december 2016. Web. 10 januari 2017. Lister, Ted en Janet Renshaw. Inzicht in chemie voor gevorderd niveau. N.p .: Nelson Thornes, 2000. Print. Pratiyogita Darpan. "Eigenschappen van elementen in relatie tot hun elektronische structuur." Competition Science Vision Aug. 1998: n. pag. Afdrukken. Pyykkö, Pekka en Michiko Atsumi. "Molecular Double-Bond Covalent Radii voor elementen Li-E112." Chemistry-A European Journal 15.46 (2009): 12770-12779.
